Физические свойства
Гидроксид натрия NaOH — белое твёрдое вещество. Если оставить кусок едкого натра на воздухе, то он вскоре «расплывается», активно поглощая атмосферную влагу. Едкий натр хорошо растворяется в воде, при этом выделяется большое количество теплоты. Раствор едкого натра мылок на ощупь.
Термодинамика растворов
ΔH0 растворения для бесконечно разбавленного водного раствора −44,45 кДж/моль.
Из водных растворов при 12,3—61,8 °C кристаллизуется моногидрат (сингония ромбическая), температура плавления 65,1 °C; плотность 1,829 г/см³; ΔH0обр −425,6 кДж/моль), в интервале от −28 до −24 °C — гептагидрат, от −24 до −17,7 °C — пентагидрат, от −17,7 до −5,4 °C — тетрагидрат (α-модификация) . Растворимость в метаноле 23,6 г/л (t = 28 °C), в этаноле 14,7 г/л (t = 28 °C). NaOH·3,5Н2О (температура плавления 15,5 °C);
Химические свойства
Гидроксид натрия (едкая щёлочь) — сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочноземельных металлов подгрупп Iа и IIапериодической системы Д. И. Менделеева, KOH (едкое кали), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдаёт электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в электрохимическом ряду активности металлов, в котором за ноль принята активность водорода.
 Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13). Основными методами определения щелочей в растворах являются реакции на гидроксид-ион (OH−), (c фенолфталеином — малиновое окрашивание и метиловым оранжевым (метилоранжем) — жёлтое окрашивание). Чем больше гидроксид-ионов находится в растворе, тем сильнее щёлочь и тем интенсивнее окраска индикатора.
Гидроксид натрия вступает в следующие реакции:
- с кислотами, амфотерными оксидами и гидроксидами
-

-
 (кислая соль, при отношении 1:1) (кислая соль, при отношении 1:1)
-
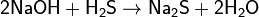 (в избытке NaOH) (в избытке NaOH)
Общая реакция в ионном виде:
-

- с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твёрдыми при сплавлении:
-
![\mathsf{2NaOH + ZnO \xrightarrow[]{^ot} Na_2ZnO_2 + H_2O}](https://upload.wikimedia.org/math/e/5/6/e56727f50686684bd96ff1ec71bc83d9.png) — при сплавлении — при сплавлении
-
![\mathsf{4NaOH + ZnO + H_2O \rightarrow Na_2[Zn(OH)_4]}](https://upload.wikimedia.org/math/a/6/2/a6268503b83ca44334a6a4fa820676b0.png) — в растворе — в растворе
- с амфотерными гидроксидами
-
![\mathsf{NaOH + Al(OH)_3 \xrightarrow[]{^ot} NaAlO_2 + 2H_2O}](https://upload.wikimedia.org/math/3/e/2/3e2bb097d07318bbfc634bf819157c58.png) - при сплавлении - при сплавлении
-
![\mathsf{3NaOH + Al(OH)_3 \rightarrow Na_3[Al(OH)_6]}](https://upload.wikimedia.org/math/1/d/d/1dd4ffc87289b70b6b8b6c21527dedb4.png) - в растворе - в растворе
- с солями в растворе:
-
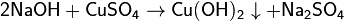
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия насульфат алюминия в водном растворе, при этом избегая избытка щёлочи и растворения осадка. Его и используют, в частности, для очистки воды от мелких взвесей.
- c неметаллами:
например, с фосфором — с образованием гипофосфита натрия:
-
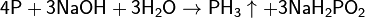
с серой:
-
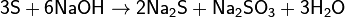
- с галогенами
-
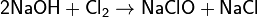 (дисмутация хлора при комнатной температуре) (дисмутация хлора при комнатной температуре)
-
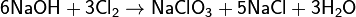 (дисмутация хлора при нагревании раствора) (дисмутация хлора при нагревании раствора)
- с металлами
Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксиалюмината натрия и водорода:
-
![\mathsf{2Al + 6NaOH + 6H_2O \rightarrow 2Na3[Al(OH)_6] + 3H_2}](https://upload.wikimedia.org/math/5/1/1/5117a5481a1f434f068183d1637b2616.png)
- с эфирами, амидами и алкилгалогенидами (гидролиз):
с жирами (омыление) такая реакция необратима, так как получающаяся кислота со щёлочью образует мыло и глицерин. Глицерин впоследствии извлекается из подмыльных щёлоков путём вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века.
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла в зависимости от состава жира.
- с многоатомными спиртами — с образованием алкоголятов:
-
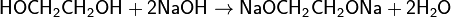
Качественное определение ионов натрия

Ионы натрия придают пламени жёлтую окраску
- По цвету пламени горелки — ионы натрия придают пламени жёлтую окраску
- С использованием специфических реакций на ионы натрия
| Реагент |
Фторид аммония |
Нитрит цезия-калия-висмута |
Ацетат магния |
Ацетат цинка |
Пикро-
лоновая кислота
|
Диокси-
винная кислота
|
Бромбензол-
сульфокислота
|
Ацетат уранила-цинка |
| Цвет осадка |
белый |
бледно-жёлтый |
жёлто-зелёный |
жёлто-зелёный |
белый |
белый |
бледно-жёлтый |
зеленовато-жёлтый |
|